Проблемы животноводства:
Одной из главных составляющих технологического цикла птицеводческого предприятия является инкубаторий. В инкубационных и выводных шкафах, залах инкубатория происходит максимальная концентрация яиц и суточных цыплят. Создаются оптимальные условия температуры и влажности для биологического объекта (эмбрион-цыпленок), а также для патогенной и условно-патогенной микрофлоры. Через яйцо передаются все бактериальные болезни птиц - как трансовариально, так и за счет контаминации скорлупы с последующим всасыванием поверхностной микрофлоры в подскорлупные оболочки. В процессе инкубации происходит максимальное увеличение микробного потенциала. Возрастает вероятность аэрогенного заражения цыплят на выводе бактериальными болезнями. Важное место в системе ветеринарно-санитарных мероприятий занимает дезинфекция, основная задача которой - уничтожение возбудителей инфекционных заболеваний. Возрастает количество штаммов микроорганизмов, устойчивых к воздействию дезинфицирующих препаратов.
Таким образом, микробиологический контроль за инкубацией яиц является важным звеном в комплексной системе мер по профилактике бактериальных болезней птиц.
Цель исследований - провести микробиологический мониторинг инкубации и изучить активность дезинфицирующих средств в отношении полевых штаммов микроорганизмов, выделенных в птицефабриках Западной Сибири.
Исследования проводили в лаборатории отдела ветеринарии ГНУ СибНИИП и на 5-ти птицефабриках Западно-Сибирского региона, работающих с яичными и мясными кроссами кур. Объектом исследования были смывы с поверхности инкубационных яиц, инкубационных и выводных шкафов, воздух выводных и инкубационных шкафов, отходы инкубации. Было проведено бактериологическое исследование 150 проб. Смывы с исследуемых поверхностей брали стерильными ватными тампонами, помещали в стерильный физиологический раствор. Микрофлору воздуха изучали седиментационным методом с использованием чашек Петри с МПА. У погибших эмбрионов исследовали хориоалантоисную жидкость и содержимое желточного мешка. Индикацию и идентификацию микроорганизмов проводили по общепринятым в микробиологии методикам с использованием простых (МПБ, МПА) и дифференциально-диагностических (Эндо, ВСА, ЖСА, Клиглера, Симмонса и др.) сред.
Дезинфицирующую активность препаратов определяли при обеззараживании поверхностей тест-объектов из дерева контаминированных тест-микробами с белковой защитой. В качестве тест-культур использовали полевые штаммы, выделенные на птицефабриках. Для белковой защиты применяли инактивированную сыворотку крови лошади. На деревянные тест-объекты наносили смесь тест-культуры и сыворотки крови лошади из расчета 1 мл 2-милиардной микробной взвеси и 0,5 мл сыворотки на один тест-объект. После полного высыхания поверхности обрабатывали рабочими растворами препаратов при помощи пульверизатора из расчета 5 мл на один тест-объект. После 1, 3 и 24-х часов экспозиции проводили контроль качества дезинфекции. Смывы с обрабатываемых поверхностей брали стерильными ватными тампонами на стерильный физиологический раствор. Исследуемый материал высевали на жидкие питательные среды (мясо-пептонный и солевой бульон). При наличие роста на жидких средах проводили подтверждающий посев на плотные дифференциально-диагностические среды: Эндо, ВСА, МПА (для энтеробактерий) и элективно-солевой агар (для стафилококков) в соответствии с действующими инструкциями.
Испытана дезинфицирующая активность 5 препаратов - дезконтен, бромосепт-50, экоцид С, дирак плюс, глютекс - в концентрациях, согласно инструкциям по применению.
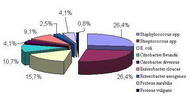
Микрофлора, выделенная в инкубаториях птицефабрик Западной Сибири, представлена патогенными и условно-патогенными микроорганизмами (рис. 1).
Наибольшее количество выделенных культур относится к представителям родов Staphylocоссus и Streptococcus - 26,4%. Остальные 47,2% выделенных культур приходится на семейство Enterobacteriаceae. Из общего числа выделенных культур на долю кишечной палочки - 15,7%. По антигенной структуре штаммы E. coli относились к серотипам О2:К2; О6:К15; О159:К; О32:К; О164:К; О115:К; О152:К. Значительное количество выделенных культур относится к роду Citrobacter - 14,8%. Из них в 10,7% случаях выделен вид Citrobacter freundii и в 4,1% - Citrobacter diversus. Представители рода Enterobacter выделены в 11,6% случаях, наибольшее количество культур приходится на Enterobacter cloacae - 9,1%. Штаммы из рода Proteus изолированы в 4,9% случаях, при этом преобладал вид Proteus mirabilis
При анализе микрофлоры в смывах с поверхности инкубационных яиц преобладали Staphylocоссus spp – 54%, E. coli - 32% и Streptococcus sрp - 27% (табл. 1). В инкубационных шкафах доминирующими видами являлись микроорганизмы из рода Enterobacter и Streptococcus sрp. Наибольшее количество различных видов микроорганизмов регистрировали в выводных шкафах: Streptococcus sрp - 33%, Citrobacter freundii - 14%, Staphylocоссus spp и Enterobacter cloacae по 8%. При исследовании отходов инкубации наиболее часто идентифицировали Staphylocоссus spp. – 16%, Citrobacter freundii - 14% и E. coli - 10 %.
Таблица 1
Состав микрофлоры в зависимости от объекта исследования
|
Объект исследова-ния |
Коли-чество проб |
Выделенные микроорганизмы, % |
||||||||
|
Staphy-locоссus spp |
Strepto-coccus sрp |
E. coli |
Citro-bacter freundii |
Citro-bacter diversus |
Entero-bacter cloacae |
Entero-bacter aerogenes |
Proteus mirabilis |
Proteus vulgaris |
||
|
Инкуба-ционные яйца |
37 |
54 |
27 |
32 |
3 |
11 |
- |
- |
- |
- |
|
Инкуба-ционный шкаф |
27 |
4 |
22 |
4 |
- |
- |
26 |
11 |
- |
- |
|
Выводной шкаф |
36 |
8 |
33 |
3 |
14 |
3 |
8 |
- |
6 |
3 |
|
Отходы инкубации |
50 |
16 |
8 |
10 |
14 |
- |
2 |
- |
2 |
- |
Определена чувствительность выделенных полевых штаммов микроорганизмов к 5-ти дезинфицирующим препаратам (табл. 2).
Препарат дезконтен 0,5%-ой концентрации был активен в отношении Proteus spp., Citrobacter spp., Enterobacter spp. через 24 часа после обработки и не оказал влияния на стафилококк и кишечную палочку. При увеличении концентрации до 1% уже через один час обеззаразил тест-объекты от Staphylococcus spp и E.coli, а через три часа - от культур Proteus spp., Citrobacter spp., Enterobacter spp.
Дирак плюс проявил высокую активность в отношении тест-культур, полностью обеззаразив поверхности тест-объектов 1%-ным раствором через один час после обработки. При концентрации 0,5% при часовой экспозиции был активен в отношении стафилококка, протея, цитробактера и через три часа – кишечной палочке и энтеробактера
Таблица 2
Бактерицидная активность препаратов в отношении полевых тест-культур
|
Дезинфектант |
Концентра-ция, % |
Тест-культуры |
||||||||||||||
|
Staphylo-coccus spp. |
E.coli |
Proteus spp. |
Citrobacter spp. |
Enterobacter spp. |
||||||||||||
|
экспозиция, час |
||||||||||||||||
|
1 |
3 |
24 |
1 |
3 |
24 |
1 |
3 |
24 |
1 |
3 |
24 |
1 |
3 |
24 |
||
|
Дезконтен |
0,5 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
- |
+ |
+ |
- |
|
1 |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
+ |
- |
- |
+ |
- |
- |
|
|
Дирак плюс |
0,5 |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
|
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Глютекс |
0,5 |
+ |
- |
- |
- |
- |
- |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
1 |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Экоцид С |
0,5 |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
1 |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Бромосепт-50 |
0,5 |
+ |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
|
1 |
- |
- |
- |
- |
- |
- |
+ |
+ |
- |
+ |
- |
- |
- |
- |
- |
Примечание: (+) – наличие роста тест-культур,
(-) – отсутствие роста тест-культур.
Испытуемые концентрации глютекса показали высокую эффективность в отношении Staphylococcus spp., E.coli, Citrobacter spp. и Enterobacter spp. Препарат в концентрации 0,5% не оказал действия на Proteus spp.
Экоцид С 1%-ной концентрации обладал выраженным бактерицидным действием в отношении всех испытуемых культур в при экспозиции три часа. При концентрациях 0,5% не обеззараживал тест-объекты от стафилококка и кишечной палочки.
Бромосепт-50 1%-ной концентрации действовал губительно на Staphylococcus spp., E.coli и Enterobacter spp. через один час после обработки, обеззаразил тест-объекты от Proteus spp. через 24 часа. При концентрации 0,5% не проявил активности в отношении кишечной палочки и цитробактера
Микробиологический мониторинг в инкубаториях птицефабрик Западной Сибири позволил установить, что доминирующими микроорганизмами являются Streptococcus sрp. - 26,4%, Staphylocоссus spp - 26,4%, E. coli - 32%, Citrobacter - 14,8%. В процессе инкубации происходит увеличение количественного и видового состав микрофлоры, которое достигает максимума при выводе. Выделенные культуры микроорганизмов проявляют неодинаковую чувствительность к различным дезинфицирующим препаратам. Регистрируются штаммы, устойчивые к воздействию дезинфиктантов. Наиболее активны в отношении выделенной микрофлоры - дирак плюс, глютекс, экоцид С.
| Читайте: |
|---|
 Более трети свиней уничтожены в очаге чумы на Ставрополье заСпециальные комиссии за три дня операции по отчуждению уничтожили более трети свиней в частных подворьях села Красногвардейское Ставропольского края... |
 Биологическое своеобразие овецСоздать благоприятные условия кормления, содержания овец и получения максимальной продукции невозможно без знания их биологического своеобразия. ... |
 ЭТО ИНТЕРЕСНО И ПОЛЕЗНО ЗНАТЬ О СВИНЬЯХСвиньи, по мнению биологов, входят в десятку наиболее умных животных. Они сообразительны, обладают хорошей памятью, прекрасно дрессируются, могут... |
Убой свиней и первичная обработка туш Перед убоем свинью не кормят 12 часов, обеспечивая свободный доступ к воде. В последние 2—3 часа животных не поят. Это необходи... |
Фосфорно-кальциевые подкормки для овец Сапропель, или озерный ил, в зависимости от места залегания содержит от 7 до 25% кальция, 0,5—1% магния, 9— 24% кремния, 0,5—2% ... |
Ответ эксперта Piginfo - кормление экструдированными кормами Экструдированные корма обладают рядом преимуществ, которые необходимы для ведения совершенного животноводства. Рассмотрим шире э... |
ГРЕНЛАНДИЯ И ГРЕНЛАНДЦЫ В 1952 г. из Северной Норвегии было завезено в Гренландию 270 домашних оленей. Через 8 лет их стало уже 3 тыс. Росту стада содей... |
КОНЮШЕННЫЙ ПРИКАЗ, ГОСУДАРСТВЕННОЕ КОННОЗАВОДСТВО И ПЕРВЫЕ И Вплоть до начала XVIII века государственное коннозаводство в России было направлено на разведение верховых лошадей для великокня... |
Типы кормления свиней В современном животноводстве внедрения действительно новой технологии - явление довольно редкое. |
|
More in: Кролиководство, Коневодство, Козоводство, Норководство, Нутриеводство, Овцеводство, Оленеводство, Свиноводство, Скотоводство |
|
«Больная мозоль» животноводства Заехав в прошлом году в гости к своим тербунским знакомым, я был шокирован увиденным. Хозяйка, подоив двух б... |
Животноводство Николаевской области: переходим на «малы За первый квартал текущего года, по сравнению с соответствующим периодом прошлого года, увеличение объемов п... |
Хлорная проблема американских птиц Пока прошло два раунда переговоров, ход которых тщательно скрывается как российской, так и американской стор... |